記憶與遺忘-1
「我們為什麼遺忘?遺忘是否只是我們大腦在演化上的缺陷?」
來自都柏林三一學院的Dr. Ryan和多倫多大學的Dr. Frankland提出了不一樣的見解─「遺忘是神經可塑性的一種形式」,發表於自然評論神經科學(Nature Reviews Neuroscience)[1]。
在談談遺忘之前,先來簡單回顧過去數十年在記憶上的研究!
「記憶是外在世界在我們大腦中留下的痕跡,連結著過去與未來」,整個過程可以粗略分為將訊息編碼(encoding)、形成記憶(acquiring)、鞏固(consolidation)、解碼(decoding)、提取記憶(retrieval),而在神經網路中形成記憶的神經元,我們就稱為記憶痕跡細胞(engram cell)。目前主流的赫布學習理論(Hebbian learning)認為:學習讓一個細胞集團(cell assembly)內的連結產生變化,一起活化的細胞就會有更強的連結(Firing together, wiring together)。也就是說,記憶存在這群細胞的連結之中,也就是突觸(神經元相連的構造)上[1]。
在老鼠的動物實驗中,科學家們便可藉由光遺傳學(以遺傳工程的方式將會被光誘導的離子通道加到神經細胞上)刺激杏仁核而將恐懼的記憶和特定的聲音或味道結合,也就是「製造記憶」,或是反過來「消除記憶」[2-3]。
在果蠅上也有一樣的方式,科學家們在給予氣味時,刺激多巴胺神經元,就可以讓果蠅學習記憶中樞的蕈狀體kenyon cell(KC)和下游的蕈狀體輸出神經元的連結強度改變,誘導記憶的產生[4-5]。
然而在神經元連結之外,也有部分的科學家認為記憶是存在神經元細胞內的!加州大學洛杉磯分校的Dr. David Glanzman在海兔(Aplysia)的研究中就發現,海兔在3次的電擊訓練後不會形成長期記憶,需要5次的訓練才行。然而若在5次的電擊訓練後,給予蛋白質合成抑制劑,則海兔不會形成較多的突觸,也不會長期記憶。這邊有趣的是緊接著再給予3次的電擊訓練,再隔一天,海兔就可以形成長期記憶了,並不需要到5次。也就是說雖然因為蛋白質抑制劑導致第一次的5次訓練沒有形成能表現出長期記憶的行為,但其實仍有長期記憶存在該細胞內,讓第二次的3次訓練就足以形成長期記憶,而這樣的記憶和基因的甲基化修飾有關[6-7]。
日本理研(Riken)的諾貝爾獎得主Tonekawa所帶領的一篇在科學發表的研究,也指出若在學習後餵食老鼠蛋白質合成抑制劑,老鼠不會形成長期記憶,然而雖然測不到長期記憶,若此時再活化engram cell,就可以再度讓老鼠形成長期記憶[8]。
簡言之,記憶的形成有主要的兩種可能的機制─改變神經元之間的連結強度、改變神經元本身的基因表達或電生理特性等。
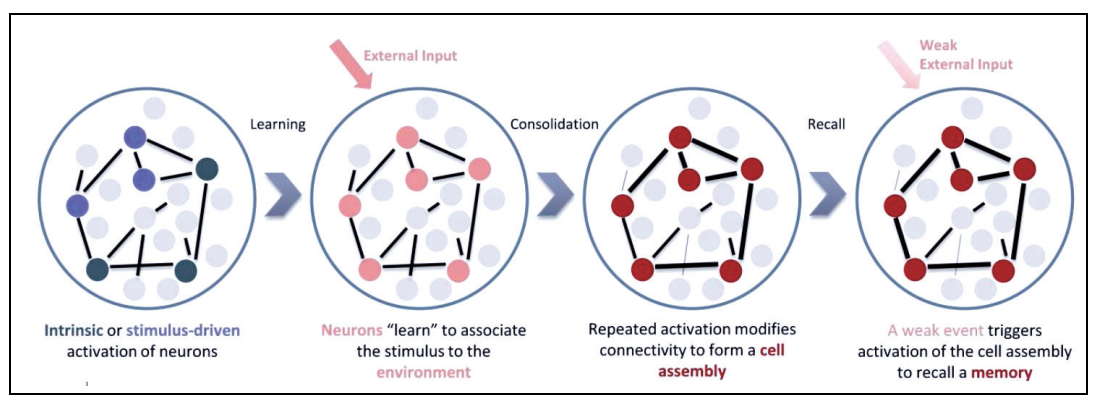 |
| 圖一、赫布學習理論示意圖[9] |
 |
| 圖二、光遺傳學示意圖[10] |
撰稿者:強敬哲(C.C. Charng)
參考資料:
1. Ryan, T. J., & Frankland, P. W. (2022). Forgetting as a form of adaptive engram cell plasticity. Nature Reviews Neuroscience, 1-14.
2. Abdou, K., Shehata, M., Choko, K., Nishizono, H., Matsuo, M., Muramatsu, S. I., & Inokuchi, K. (2018). Synapse-specific representation of the identity of overlapping memory engrams. Science, 360(6394), 1227-1231.
3. Ramirez, S., Liu, X., Lin, P. A., Suh, J., Pignatelli, M., Redondo, R. L., ... & Tonegawa, S. (2013). Creating a false memory in the hippocampus. Science, 341(6144), 387-391.
4. Hige, T., Aso, Y., Modi, M. N., Rubin, G. M., & Turner, G. C. (2015). Heterosynaptic plasticity underlies aversive olfactory learning in Drosophila. Neuron, 88(5), 985-998.
5. Aso, Y., Ray, R. P., Long, X., Bushey, D., Cichewicz, K., Ngo, T. T., ... & Rubin, G. M. (2019). Nitric oxide acts as a cotransmitter in a subset of dopaminergic neurons to diversify memory dynamics. Elife, 8, e49257.
6. Pearce, K., Cai, D., Roberts, A. C., & Glanzman, D. L. (2017). Role of protein synthesis and DNA methylation in the consolidation and maintenance of long-term memory in Aplysia. Elife, 6, e18299.
7. Chen, S., Cai, D., Pearce, K., Sun, P. Y., Roberts, A. C., & Glanzman, D. L. (2014). Reinstatement of long-term memory following erasure of its behavioral and synaptic expression in Aplysia. Elife, 3, e03896.
8. Ryan, T. J., Roy, D. S., Pignatelli, M., Arons, A., & Tonegawa, S. (2015). Engram cells retain memory under retrograde amnesia. Science, 348(6238), 1007-1013.
9. Palchaudhuri, S. (2020). The Mind Behind the Hebbian Synapse. Resonance, 25(9), 1215-1230.
10. Lim, D. H., & LeDue, J. (2017). What is optogenetics and how can we use it to discover more about the brain. Front Young Minds, 5.



留言
張貼留言